Cell Metab.|复旦大学储以微、骆菲菲团队:Foxp3改造CAR-T,从「能量危机」到「代谢续航」的实体瘤治疗新路径
英文标题:Foxp3 confers long-term efficacy of chimeric antigen receptor-T cells via metabolic reprogramming
中文标题:Foxp3通过代谢重编程赋予嵌合抗原受体T细胞长期疗效
发表期刊:Cell Metabolism
影响因子:27.7
客户单位:复旦大学生物医学研究院/基础医学院、复旦大学附属华山医院
百趣提供服务:经典脂质组
研究背景
嵌合抗原受体T细胞(Chimeric Antigen Receptor-T, CAR-T)免疫疗法在血液癌症治疗中效果显著,但用于实体瘤治疗时面临困境。肿瘤微环境(Tumor Microenvironment, TME)的低氧和营养匮乏致使CAR-T细胞耗竭,限制了治疗效果。调节性T细胞(Regulatory T Cells, Tregs)可在TME中生存和发挥作用,其代谢模式独特,Foxp3作为Tregs的关键转录因子,对维持Tregs代谢和功能意义重大。因此,探究将Tregs代谢优势引入CAR-T细胞,借助调控其代谢来克服TME障碍、防止细胞耗竭,有望提升CAR-T细胞在实体瘤治疗中的疗效。
研究结果
1、CAR-TFoxp3细胞获得了与CAR-TConv细胞不同的代谢特征
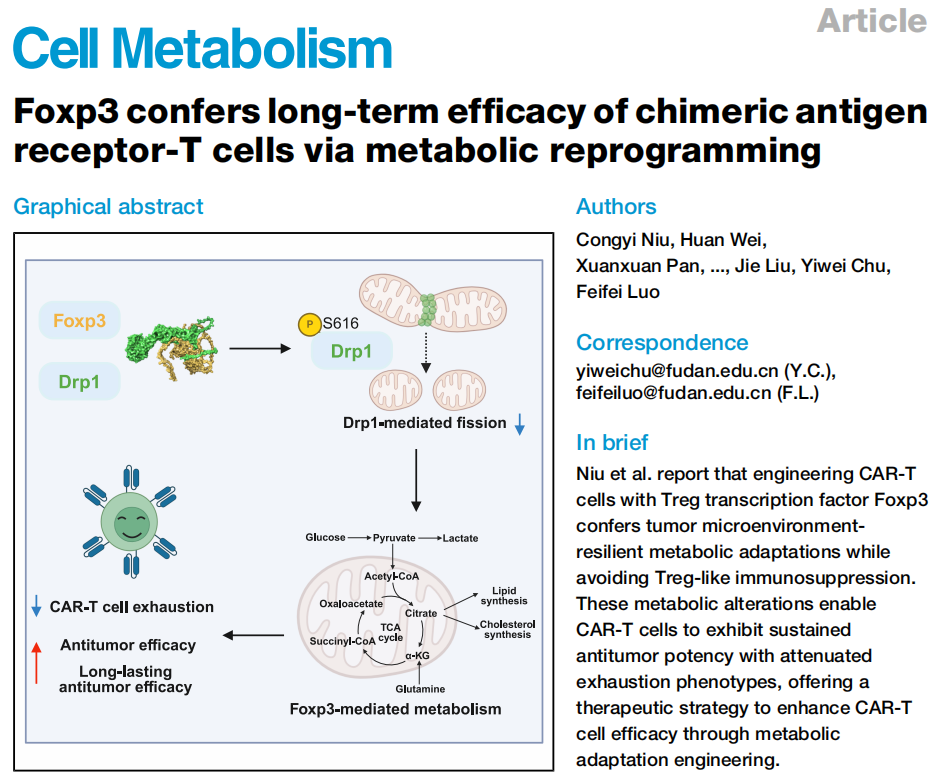
研究者为探究Foxp3过表达对CAR-T细胞代谢的影响,选用具有更强扩增能力和持久性的第三代CAR。通过激活健康供体的人T淋巴细胞,分别用GPC3-CAR感染得到常规的 GPC3-CAR-T(CAR-TConv)细胞,用GPC3-CAR和Foxp3共同感染培育出GPC3-CAR-TFoxp3(CAR-TFoxp3)细胞(图1A)。
在检测细胞代谢参数时发现,GPC3蛋白刺激后,CAR-TFoxp3细胞的细胞外酸化率(Extracellular Acidification Rate, ECAR)和耗氧率(Oxygen Consumption Rate, OCR)低于CAR-TConv细胞(图1B)。利用LC-MS评估[U-C13]葡萄糖和[U-C13]谷氨酰胺代谢通量,结果显示,CAR-TFoxp3细胞从[U-C13]葡萄糖产生的相关代谢产物低于CAR-TConv细胞,且谷氨酰胺进入三羧酸(Tricarboxylic Acid, TCA)循环的量减少,相关代谢产物水平也更低(图1C-F)。添加丙酮酸也无法恢复CAR-TFoxp3细胞降低的ECAR和OCR。同时,CAR-TFoxp3细胞内ATP水平更低,NAD/NADH比值更高,表明其糖酵解和氧化磷酸化(Oxidative Phosphorylation, OXPHOS)适度下调(图1G)。
进一步利用非靶LC-MS筛选,发现CAR-TFoxp3细胞中与脂质和氨基酸代谢相关的代谢物表达有差异,涉及甘油磷脂代谢等多条途径。脂质组学及BODIPY染色证实,CAR-TFoxp3细胞甘油三酯水平和细胞内脂滴含量增加(图1H-I)。用二氯乙酸钠(Sodium Dichloroacetate, DCA)处理后,CAR-TFoxp3细胞脂滴含量降低,暗示Foxp3介导的OXPHOS减少与脂质代谢上调有关(图1I)。同时,CAR-TFoxp3细胞线粒体膜电位和质量降低,线粒体功能改变(图1J) 。综上,CAR-TFoxp3细胞的代谢特征与调节性T细胞(Tregs)相似,与CAR-TConv细胞不同。
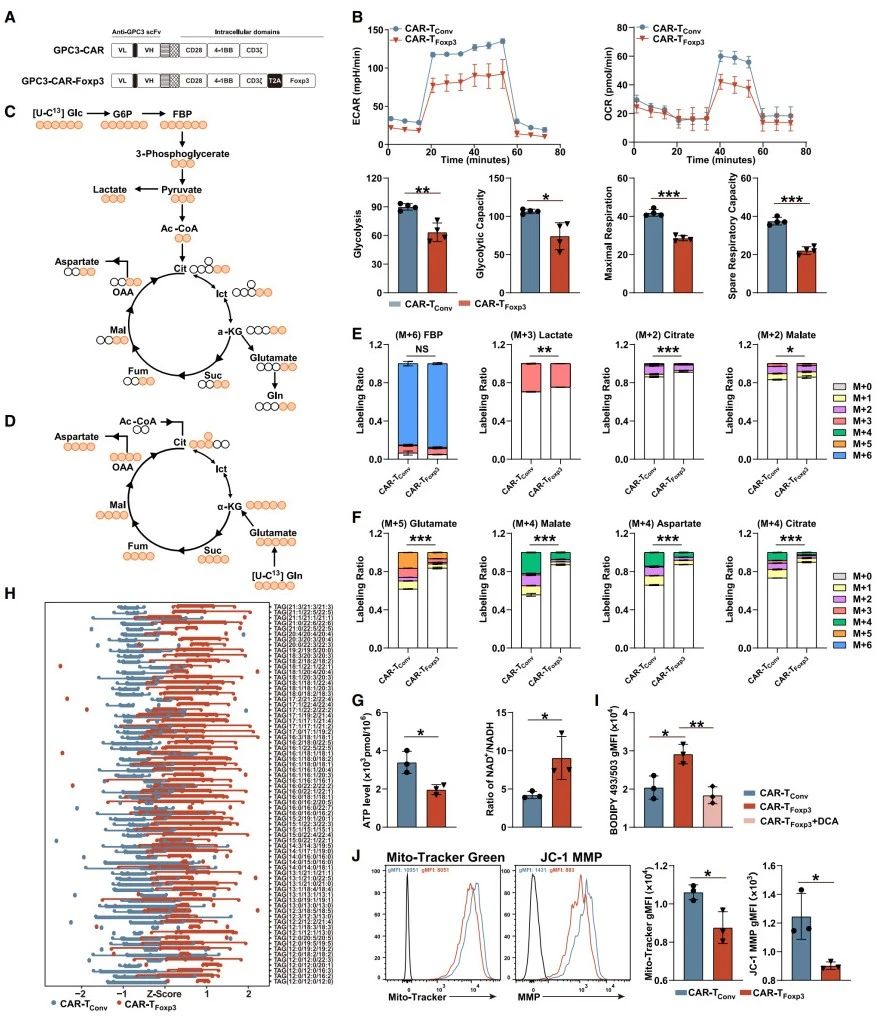
图1.CAR-TFoxp3细胞获得了与CAR-TConv细胞不同的代谢特征
2、CAR-TFoxp3细胞的代谢特征由Foxp3与Drp1的结合所决定
研究者探究CAR-TFoxp3细胞代谢模式与Foxp3和线粒体动力学相关蛋白的关系,发现其代谢重编程由Foxp3与Drp1的结合介导。
探究Foxp3与线粒体动力学相关蛋白的相互作用:鉴于CAR-TFoxp3细胞线粒体膜电位(Mitochondrial Membrane Potential, MMP)和质量改变,研究人员探究Foxp3对Opa1、Drp1、Mfn1和Mfn2等线粒体动力学相关蛋白的作用,以明确其代谢模式的成因。双分子荧光互补(Bimolecular Fluorescence Complementation, BiFC)实验显示,在HEK293T细胞中Foxp3仅与Drp1存在相互作用(图2A),谷胱甘肽S-转移酶下拉(Glutathione S-transferase Pull-down Assay, GST pull-down Assay)实验加以验证(图2B)。构建融合蛋白观察到Drp1 定位于细胞质,Foxp3在细胞质和细胞核均有分布(图2C),二者在细胞质共定位,此现象经HEK293T细胞免疫荧光实验(图2D)以及以Tregs为对照的CAR-T细胞实验(图2E)证实。
研究Foxp3对Drp1磷酸化及线粒体的影响:已知Drp1丝氨酸616位点磷酸化促线粒体裂变,637位点磷酸化助融合。研究发现,Foxp3不影响Drp1表达及丝氨酸637位点磷酸化,却显著降低丝氨酸616位点磷酸化水平(图2F-M)。利用AlphaFold软件预测结构和对接结果表明,丝氨酸616位点磷酸化影响Foxp3与Drp1结合稳定性。显微镜观察显示,CAR-TFoxp3细胞线粒体聚集伸长且数量少于CAR-TConv细胞(图2G-I)。此外,Foxp3对Drp1上游激酶CDK1和ERK1/2无明显抑制作用(图2M)。综合这些结果可知,Foxp3与Drp1结合可能影响Drp1磷酸化和线粒体裂变,进而重编程CAR-T细胞代谢。
确定Foxp3与Drp1结合位点及对代谢的影响:为确定Foxp3与Drp1结合位点及其对代谢的影响,研究人员利用薛定谔软件进行对接研究,筛选出5个结合稳定性最高的构象。通过构建多种Foxp3序列部分缺失质粒,BiFC实验发现缺失340-390位氨基酸片段会破坏二者相互作用。构建缺失该片段的CAR-TFoxp3(340-390)细胞后,观察到其融合线粒体消失、线粒体数量恢复、脂滴含量降低,线粒体质量、MMP、ECAR和OCR增加(图2G-L),且Drp1丝氨酸616位点磷酸化增强(图2M)。研究还预测Foxp3的340-390片段与Drp1的600-620片段结合,构建缺失600-620片段的Drp1变体后,其BiFC平均荧光强度显著降低,表明该片段参与二者相互作用,解释了Drp1丝氨酸616位点磷酸化下调的原因(详情可查阅补充材料)。
综上,CAR-TFoxp3细胞代谢重编程由Foxp3与Drp1结合介导。
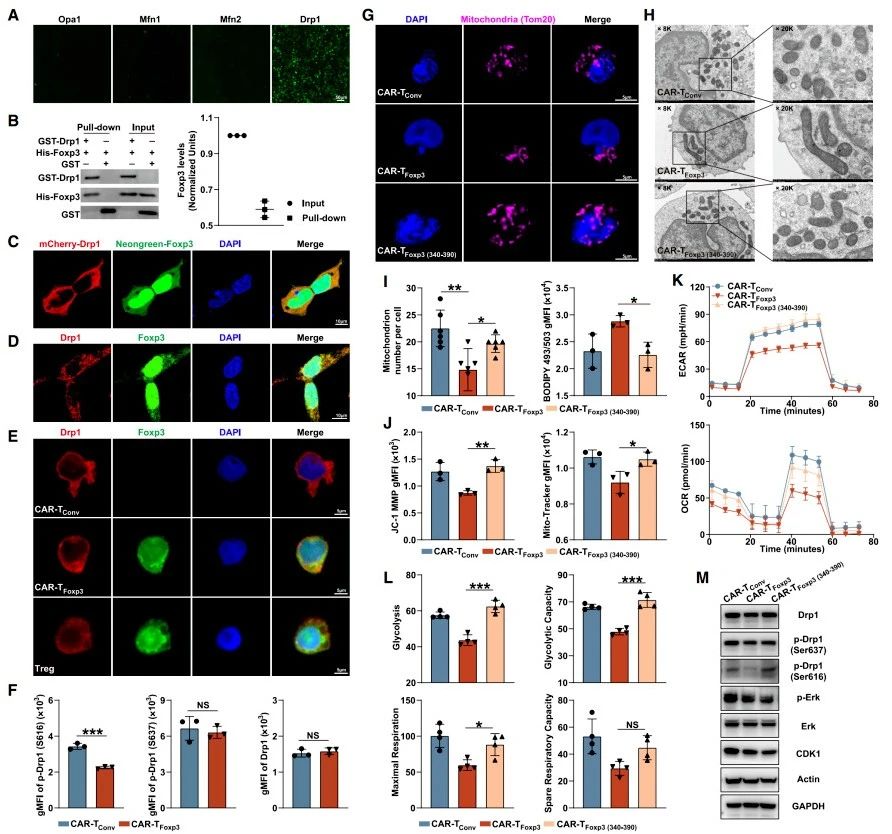
图2.CAR-TFoxp3细胞的代谢特征由Foxp3与Drp1的结合决定
3、CAR-TFoxp3细胞不会获得Tregs的染色质可及性和抑制功能
染色质可及性分析:研究人员利用ATAC-seq技术分析Tregs、CAR-TConv和CAR-TFoxp3细胞全基因组染色质可及性,发现ATAC-seq峰主要集中于启动子、内含子和远端基因间区域,降维分析可清晰区分三类细胞(图3A)。转录起始位点(TSS)周围平均ATAC-seq信号显示,Tregs读数浓度低于其余两组,而CAR-TConv与CAR-TFoxp3细胞信号相近(图3B)。深入分析发现,Tregs中显著升高的峰高度富集于TRPS1、RUNX2等转录因子识别基序,这些基序与Tregs的抑制功能相关。然而,在CAR-TFoxp3细胞中,这些基序并不富集,表明二者染色质格局存在差异(图3C-E)。
细胞因子与标志物检测:检测T细胞相关标志物和细胞因子发现,与Tregs相比,CAR-TFoxp3细胞分泌的IL-10、TGF-β水平较低,CTLA-4抑制性受体表达也降低,且与CAR-TConv细胞情况相近(图3F)。GPC3抗原刺激后,CAR-TFoxp3、CAR-TConv和Tregs细胞中CD39和CD73表达无显著差异(图3F)。
抑制功能验证:通过共培养实验验证CAR-TFoxp3细胞对TConv细胞增殖的抑制作用,结果显示CAR-TFoxp3组中TConv细胞增殖明显强于Tregs组,与CAR-TConv组相近,表明CAR-TFoxp3细胞无抑制作用。
差异峰与代谢物分析:研究发现,在CAR-TFoxp3细胞上调、CAR-TConv细胞下调的峰中,仅有少量能在Tregs中共同富集(图3G-H)。通路富集分析表明这些峰集中于细胞代谢过程(图3I)。质谱检测发现,CAR-TFoxp3细胞中乳酸、富马酸和NADH水平显著低于CAR-TConv细胞,或可解释CAR-TFoxp3细胞染色质可及性与代谢相关的变化。
综上,CAR-TFoxp3细胞在染色质格局和抑制功能上与Tregs存在根本差异,不会转化为Tregs。
图3.CAR-TFoxp3 细胞未获得Tregs的染色质可及性和抑制功能
4、Foxp3介导的代谢下调了CAR-TFoxp3细胞中与耗竭相关的抑制性分子的表达
接下来,研究者探究了Foxp3介导的代谢对CAR-TFoxp3细胞活化和功能的影响。
细胞表型与功能检测:将CAR-TFoxp3和CAR-TConv细胞与GPC3+Huh7肿瘤细胞孵育72小时后,CAR-TFoxp3细胞的CD27、CD28等活化及表型标志物和BCL-6转录因子水平更高,CD95、EOMES等水平更低(图4A-B)。细胞毒性评估表明,CAR-TFoxp3细胞与CAR-TConv细胞杀伤能力相似(图4C) ,但前者释放的颗粒酶B、IFN-γ等细胞因子更少(图4D)。
耗竭标志物分析:GPC3抗原刺激72小时后,CAR-TFoxp3细胞中PD-1、LAG-3等耗竭标志物表达及三重/双重阳性比例均低于CAR-TConv细胞(图4E-F);经三轮抗原刺激后,第12天时CAR-TFoxp3细胞耗竭分子减少、干细胞标志物CD62L增加,而CAR-TFoxp3(340–390)细胞未维持该优势(图4G)。
机制探究:用P110处理增加Drp1丝氨酸616位点磷酸化后,CAR-TFoxp3细胞耗竭标志物显著上升,CAR-TConv细胞无变化(图4H);DCA处理或抑制脂肪酸β氧化,仅使CAR-TFoxp3细胞耗竭标志物表达增加(图4I)。表明Foxp3与Drp1的相互作用、p-Drp1受损及Foxp3介导的代谢模式,共同作用下调CAR-TFoxp3细胞耗竭标志物。
综上,Foxp3介导的代谢不影响CAR-TFoxp3细胞毒性,但可下调其与耗竭相关的抑制性分子表达,对细胞功能调控具有重要意义。
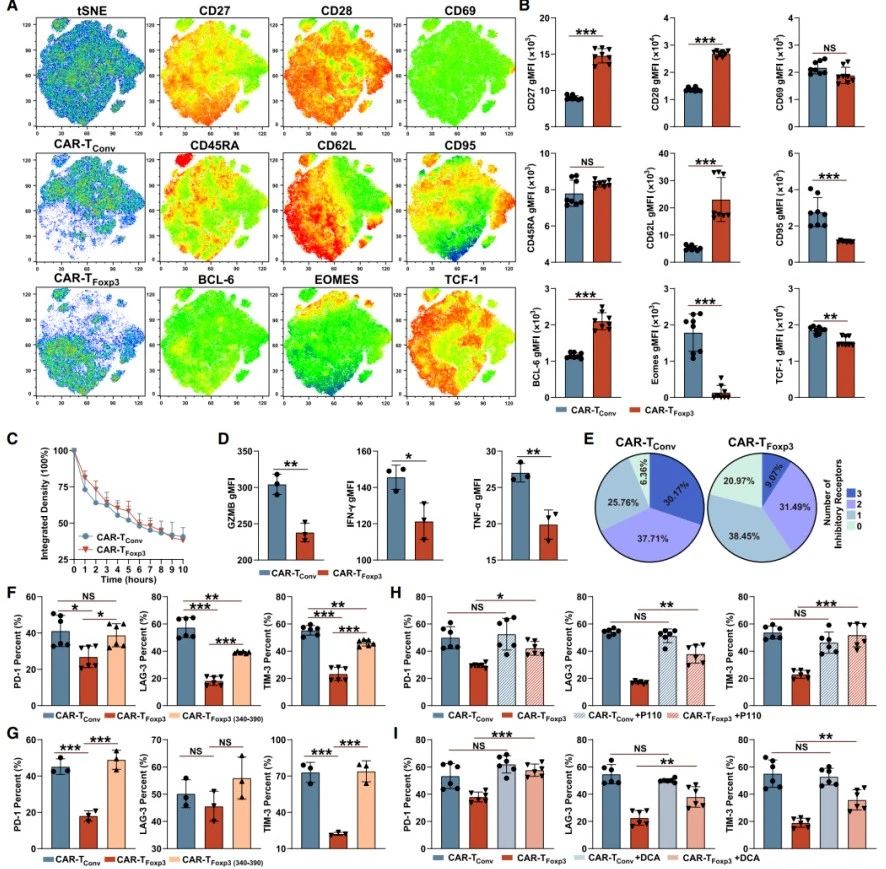
图4. Foxp3介导的代谢下调了CAR-TFoxp3细胞中与耗竭相关的抑制分子的表达
5、CAR-TFoxp3细胞在体内表现出强大的抗肿瘤活性,且耗竭标志物水平降低
通过小鼠皮下异种移植瘤模型及后续分子检测,证实CAR-TFoxp3细胞在体内抗肿瘤能力更强且耗竭程度更低。
体内抗肿瘤效果验证:构建小鼠皮下肿瘤模型,在肿瘤体积约100mm3时(图5A),注射不同T细胞。结果显示,CAR-TFoxp3细胞治疗组肿瘤生长最慢(图5B-C),肿瘤重量更轻(图5D),表明其具有更强的体内抗肿瘤活性 。
细胞表型与功能分析:第20天对肿瘤组织进行流式细胞术分析发现,与CAR-TConv细胞相比,CAR-TFoxp3细胞CD28表达显著增加,PD-1、LAG-3、TIM-3等耗竭标志物明显降低(图5E-G),三重或双重阳性率也大幅下降(图5F);共聚焦免疫荧光分析显示,CAR-TFoxp3细胞中PD-1与CD3积分密度比值更低(图5H-I),进一步说明其耗竭程度低。
转录组水平探究:对肿瘤浸润的CAR-T细胞进行RNA-seq,主成分分析明确区分CAR-TFoxp3与CAR-TConv细胞;CAR-TFoxp3细胞中Foxp3持续高表达,TIM-3等耗竭相关基因显著下调(图5J),基因集富集分析证实其耗竭状态更低(图5K)。此外,转录组分析表明CAR-TFoxp3细胞与Tregs存在根本差异,但部分上调基因在细胞代谢通路富集,提示二者代谢特征有相似之处(图5L);同时,CAR-TFoxp3细胞中线粒体相关通路显著富集,且Foxp3靶基因在两类细胞中的表达有差异。
综上,CAR-TFoxp3细胞在体内展现出优于CAR-TConv细胞的抗肿瘤能力,且耗竭相关抑制性分子表达更低,在肿瘤免疫治疗中具有潜在优势。
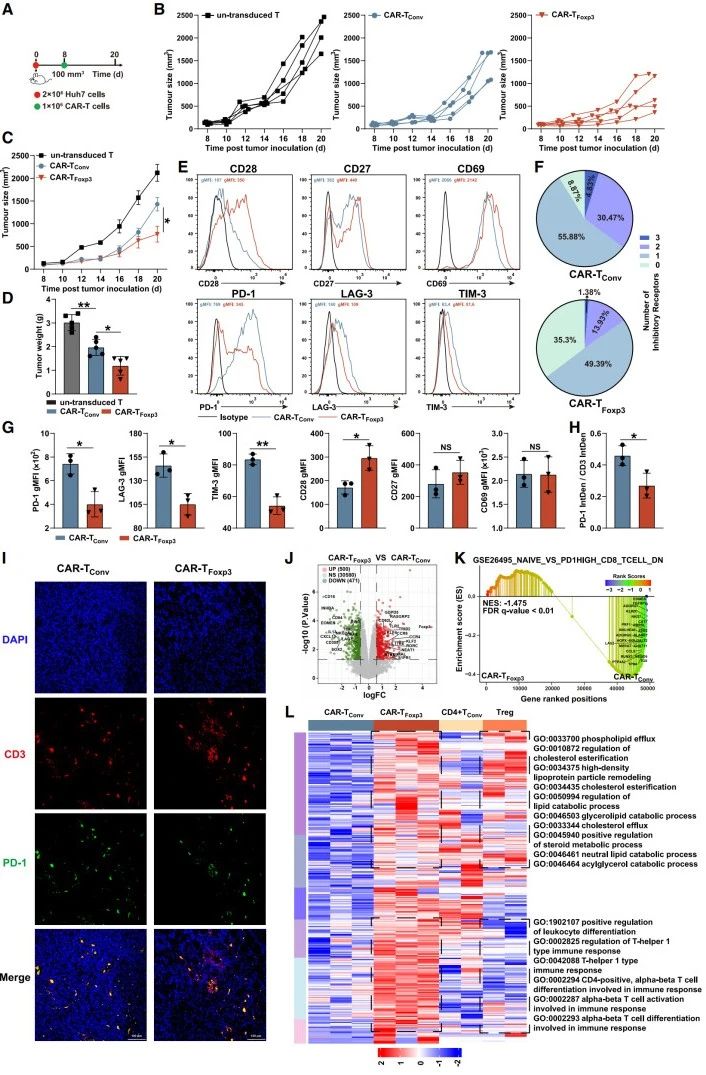
图5.CAR-TFoxp3细胞在体内展现出强大的抗肿瘤活性,且耗竭标记物减少
6、Foxp3在体内使CAR-TFoxp3细胞维持持久的抗肿瘤效果以及较低水平的耗竭标志物
肿瘤再攻击模型实验:当肿瘤体积达50mm3时(图6A),预先给予CAR-T细胞,CAR-TFoxp3组肿瘤清除速度略快于CAR-TConv组(图6B)。肿瘤清除后,两组外周血CAR-T细胞计数无差异(图6C),但CAR-TFoxp3组初始/干细胞记忆T细胞比例更高,终末效应记忆T细胞比例更低(图6D-E)。第29天再次用肿瘤细胞攻击,CAR-TFoxp3组肿瘤生长最慢(图6F)。
验证Foxp3关键作用:将CAR-TFoxp3(340–390)、CAR-TFoxp3和CAR-TConv细胞注射到荷瘤小鼠(图6G),初期肿瘤均快速清除(图6H)。再次攻击后,CAR-TFoxp3(340–390)组肿瘤生长速度与CAR-TConv组相似且快于CAR-TFoxp3组(图6I),其TIM-3和LAG-3比例与CAR-TConv组相当且高于CAR-TFoxp3组。
综上,CAR-TFoxp3细胞增强的抗肿瘤效果及较低的耗竭相关抑制分子水平依赖于Foxp3的第340-390位残基,证实了Foxp3在CAR-T细胞抗肿瘤活性中的关键作用。
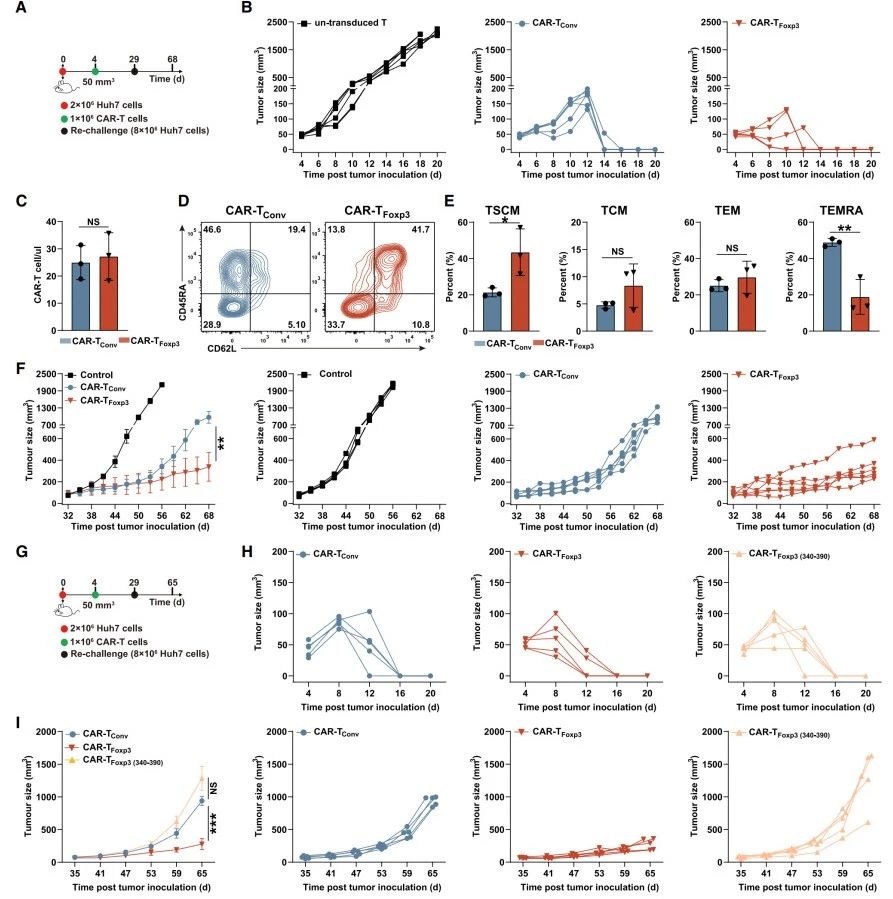
图6.Foxp3介导CAR-TFoxp3细胞在体内的持久抗肿瘤效应与低耗竭特性
7、人源化NSG模型下CAR-TFoxp3细胞的双重特性——强抗癌、无免疫抑制
模型构建与细胞检测:使用CD34造血干细胞构建人源化NSG小鼠,在外周血和脾脏中检测到多种人类免疫细胞,外周血中人类免疫细胞(hCD45+)占总免疫细胞比例超60%,脾脏中人类免疫细胞占活细胞比例可达80%。
抗肿瘤效果:建立皮下异种移植瘤模型并给予不同CAR-T细胞治疗(图7A),CAR-TFoxp3细胞显著抑制肿瘤生长,五只小鼠中有两只完全缓解,其余三只肿瘤大小也明显减小(图7B-C)。
细胞及因子分析:第25天分析显示,与CAR-TConv组相比,CAR-TFoxp3细胞耗竭相关抑制分子(PD-1和LAG-3)水平更低,肿瘤浸润的CD4+T细胞更多(图7D-F);两组肿瘤浸润的人类免疫细胞组成相似(图7F),小鼠脾脏重量和重要器官无显著差异(图7E)。多重细胞因子检测表明,CAR-TFoxp3组中TNF-α和IL-10分泌量更低,细胞因子水平更稳定,IL-1β、IL-4等多种细胞因子平均水平低于CAR-TConv组,提示细胞因子风暴减轻,而对CAR-T细胞活化增殖关键的IL-2浓度两组无显著差异(图7G)。
综上,CAR-TFoxp3细胞在人源化NSG模型中展现出增强的抗肿瘤活性,同时维持安全性,未诱导免疫抑制。
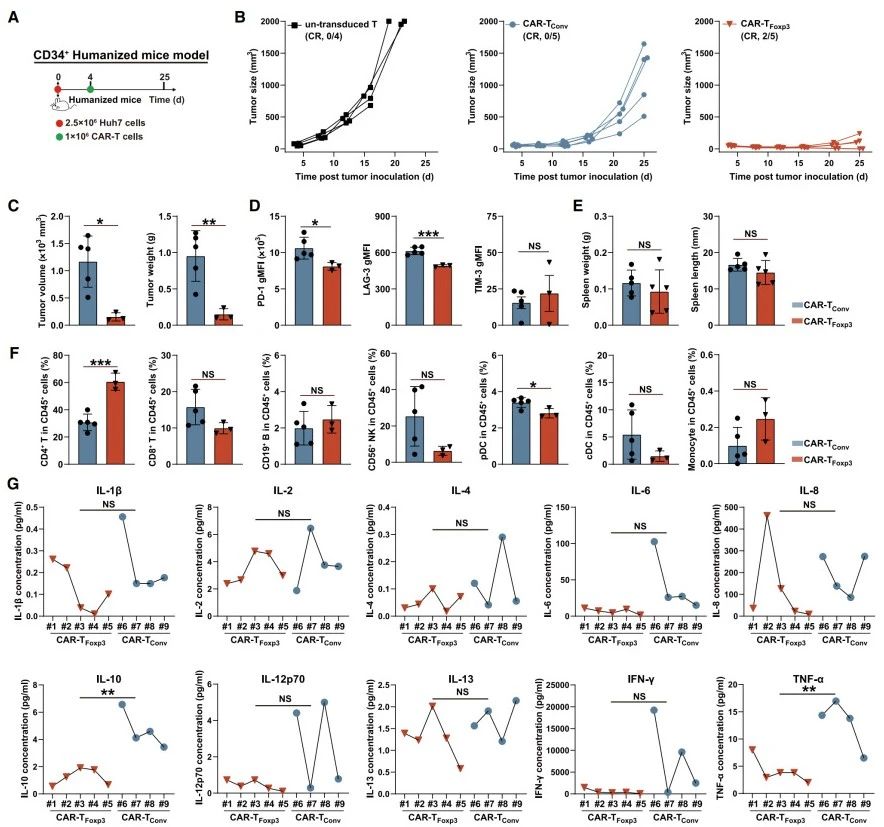
图7.人源化NSG模型中CAR-TFoxp3细胞的强效抗肿瘤活性与非免疫抑制特性
研究结论
本研究围绕CAR-TFoxp3细胞的抗肿瘤作用展开深入探究。通过构建小鼠皮下异种移植瘤模型、肿瘤再攻击模型以及人源化NSG小鼠模型,从多维度验证了CAR-TFoxp3细胞的特性。在小鼠皮下异种移植瘤模型中,CAR-TFoxp3细胞肿瘤抑制效果显著,细胞耗竭程度低,且在转录组水平展现出独特的基因表达模式。肿瘤再攻击模型证实其抗肿瘤作用的持久性,且该效果依赖于Foxp3的第340-390位残基。在人源化NSG模型中,CAR-TFoxp3细胞不仅能有效抑制肿瘤生长,实现部分小鼠肿瘤完全缓解,还能维持较低的耗竭标志物水平,减轻细胞因子风暴 ,且不诱导免疫抑制,同时对其他免疫细胞组成及小鼠重要器官无不良影响。这些结果表明,CAR-TFoxp3细胞在体内具有优异的抗肿瘤活性和良好的安全性,为肿瘤免疫治疗提供了新的潜在策略和理论依据。
END
Peng 撰文
Tang 校稿
